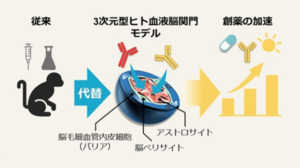
東京薬科大学大学院 薬学研究科(大木聖矢[大学院SPRINGスカラシップ研究学生]、降幡知巳教授ら)およびJCRファーマ株式会社(薗田啓之ら)の研究グループは、生体模倣システムに基づくヒト血液脳関門モデルを用いて抗体の脳移行性を評価し、その結果が霊長類(サル)での同抗体評価結果と一致することを世界で初めて実証しました。この成果は、本モデルを用いることで、ヒトに投与せずともヒト脳に届く抗体を見出し得ることを意味しています。本モデルは、脳疾患に対する抗体医薬開発を飛躍的に促進させる新たな創薬基盤技術となると期待されます。また、本成果は、日米欧規制当局による動物実験削減・創薬効率化政策を後押しする科学的エビデンスとなるとも期待されます。本内容は、2026年1月24日付けで国際学術誌『Fluids and Barriers of the CNS』に掲載されました。
研究成果のポイント
生体模倣システム(3次元型ヒト血液脳関門モデル)で抗体の脳移行性を的確に評価し、そのサル生体における試験結果との整合性を世界で初めて実証
脳疾患治療用抗体の開発における生体模倣システムを用いた動物実験代替と効率化の可能性を明示
日米欧規制当局が推進する動物実験削減・創薬効率化政策前進への貢献
研究の背景
脳疾患治療薬の開発では、血液脳関門(Blood-brain barrier, BBB*1)の突破が最大の課題です。BBBは脳を守るバリアとして機能していますが、このバリアは薬に対しても働き、事実上ほとんどの薬は脳に届きません。これに対して、薬を脳に届けるための薬物送達キャリア*2の開発が進んでおり、中でもヒトトランスフェリン受容体を標的とした抗体(hTfRMAb*3)が注目されています。しかし、動物とヒトとの種差(つまり動物で上手くいってもヒトでは上手くいかない)の問題や開発コストなどが障壁となり、薬物脳送達キャリアの開発は難航しています。
さらに上述の種差の問題や動物倫理の観点から、米国FDAは、医薬品開発における動物実験代替のロードマップを発表し、生体模倣システムを含む新たな創薬アプローチ(New Approach Methodologies、NAMs)の創薬研究への実装を推進する方針を明確にしています。EUのEMAも同様の行動計画を公表し、日本でも同様の準備が進められています。こうした背景から、薬物脳送達キャリアの開発においても、ヒト細胞ベースのNAMsの確立が急務とされています。
これにあたり当研究室ではこれまでに、ヒト可逆的不死化*4脳毛細血管内皮細胞*5・ペリサイト・アストロサイトから構成される3次元型階層スフェロイド型BBBモデル(hMCS-BBBモデル*6、生体模倣システムの一種)を開発し、薬物脳送達キャリアのBBB透過性評価への応用可能性を検証してきました。しかし、細胞レベル(in vitro)で得られた結果が、どの程度生体(in vivo)を反映するか明らかではありません。一方、未承認薬をヒトに投与してデータを得ることは出来ません。
そこで本研究では、薬物脳送達キャリアのモデルとしてhTfRMAbを用い、ヒトに近い霊長類であるサル生体における脳移行性データとの比較検証を行うことで、hMCS-BBBモデルがどれだけ生体を反映し得るか明らかとすることを目的としました。なお、本研究はJCRファーマ株式会社との共同研究により実施しました。
主な研究成果
本研究では、hMCS-BBBを用いて4種の抗ヒトトランスフェリン受容体モノクローナル抗体(hTfRMAb-1〜4、JCRファーマ株式会社提供)のBBB移行性を評価しました。その結果、hTfRMAb-1、-3、-4はBBB透過性を示し、hTfRMAb-2は透過性を示さないことが明らかになりました(前項の図参照)。この結果をサル生体の実験結果と比較したところ、両試験系における抗体の脳移行性・非移行性がきれいに一致することが明らかとなりました。つまり、hMCS-BBBモデルでhTfRMAbの脳移行性を調べれば、そのサル生体における脳移行性がわかることを意味しています。サルがヒトと近いことを踏まえれば、このことはヒトに当てはめることができる可能性があります。したがって、ヒト細胞ベースのhMCS-BBBモデルを活用することにより、動物実験に頼らずとも、ヒトに実際に投与せずとも、薬物脳送達キャリアがヒト生体の脳に届くかを創薬早期に的確に見極めることが可能になると期待されます。
また、本研究を通じて、薬物脳送達キャリアに関する新たな知見も見出しました。今回用いたhTfRMAbはいずれも“世界的にも類をみない超高親和性”抗体で、これほどの親和性を有する抗体が脳移行性を示す報告はこれまでにありません。一方、本研究結果においては、hTfRに対して同様に超高親和性を有する抗体であっても脳移行性には差異が認められています。このことから、脳移行性を示す抗体には、“標的親和性以外にも重要な何か”が存在すると考えられ、これを明らかとすることが薬物脳送達キャリアの開発に必要であると考えられます。
今後の展望
hMCS-BBBモデルは際限なく作ることが可能ですし、理論上、不死化細胞以外の細胞(たとえばiPS由来の細胞)でも同様に作製することが可能です。本モデルを創薬研究で最大限活用すれば、多数の薬物脳送達キャリア候補を短期間でスクリーニング・検証することができ、これにより薬物脳送達キャリア開発における効率と経済性が飛躍的に向上すると期待されます。また、本モデルを用いて今回明らかとなった脳移行性hTfRMAbと非移行性hTfRMAbの違いを解析することで、“脳移行性を示す抗体に必要な何か”を明らかとすることができると期待されます。これらはいずれも新たな脳疾患治療薬の開発促進に資するものです。
したがって、hMCS-BBBモデルは、脳疾患治療薬開発における次世代評価プラットフォームとして、アルツハイマー病、パーキンソン病、脳腫瘍など様々な脳疾患に対する新薬創出の加速、ひいてはこれら疾患の克服に貢献すると期待されます。
また、本成果は、創薬におけるNAMs開発・実装の動向にも合致しており、国際的な動物実験削減・創薬効率化政策を前進させる大きな一助となると考えられます。
論文情報
論文タイトル:Translational applicability of human blood-brain barrier spheroid models for the development of brain-penetrant therapeutic antibodies
著者:Seiya Ohki, Tomoki Fukatsu, Hideto Morimoto, Masafumi Kinoshita, Atsushi Imakiire, Ryuji Yamamoto, Hanae Morio, Hiroyuki Sonoda, Tomomi Furihata*(* 責任著者)
掲載誌:Fluids and Barriers of the CNS
DOI:10.1186/s12987-025-00752-8
用語説明
*1 血液脳関門(BBB):中枢神経系機能の維持と保護のために、脳内と循環血中の物質の往き来を制限する関門構造であり、脳血管の血管内皮細胞を実体とする。関門機能の分子実体は、脳血管内皮細胞同士の強固な結合(密着結合)および細胞に存在する薬物排出トランスポーターである。脳血管内皮細胞がこれら関門機能を発揮するためには、脳周皮細胞(ペリサイト)やアストロサイトなど他の脳内細胞による助けが必要とされる。
*2 薬物送達キャリア:高分子や構造改変が困難な薬剤を内包または結合させ、標的とする組織に届ける能力を持つ分子を指す。脳を標的とした薬物送達キャリアを用いることで、様々な薬剤を十分量脳内へと送達させることが可能になると期待されている。
*3 ヒトトランスフェリン受容体標的抗体(hTfRMAb):トランスフェリン受容体(TfR)は脳毛細血管内皮細胞の表面に発現している受容体で、鉄と結合したトランスフェリンを脳内に運ぶ役割を担っている。このヒトTfRを認識するモノクローナル抗体(hTfRMAb)は、受容体介在性の経細胞輸送経路を利用して血液脳関門を透過し、脳内へと到達することができる。そのため、薬物を脳へ運ぶ薬物送達キャリアとして有望視されている。現在、複数のhTfRMAbが臨床開発段階にあり、アルツハイマー病や希少疾患などの治療への応用が期待されている。
*4 可逆的不死化細胞:ヒト不死化細胞は、ヒト初代培養細胞への不死化遺伝子導入により作成することができる。この際、培養条件に依存して機能を発揮する不死化遺伝子を導入することで、可逆的不死化細胞を作成することができる。即ち、一定の条件下では永続的な増殖能を発揮するものの、その条件を解除すると不死化シグナルが消え、理論上、初代培養細胞の状態に戻る。不死化遺伝子の機能を限定的な条件下で発揮させる方法は複数あり、温度を用いる方法(本研究で使用)や遺伝子組み換えを用いる方法などが知られている。
*5 脳毛細血管内皮細胞:脳の毛細血管を構成している血管内皮細胞。脳全域に薬が行き渡るためには、薬は脳毛細血管内皮細胞による血液脳関門を透過する必要がある。そのため、中枢神経系疾患に対する治療薬開発や薬物治療を考える上では、薬がどれだけ血液脳関門を透過するかが重要である。
*6 階層スフェロイド型ヒト血液脳関門モデル(hMCS-BBBモデル):3種のヒト可逆的不死化血液脳関門細胞(脳毛細血管内皮細胞、ペリサイト、アストロサイト)を立体的かつ階層状に配置することにより構築された、ヒト生体の血液脳関門を模倣する3次元型の評価モデル。従来の平面的な培養系と異なり、生体内の立体的な細胞配置と細胞間相互作用を再現しているため、より生体に近い環境で薬物の脳移行性を評価できる。
研究に関するお問い合わせ
東京薬科大学 薬学部 創薬基盤科学教室 教授 降幡知巳(ふりはた ともみ)
電話:042-676-5680
メールアドレス:tomomif[at]toyaku.ac.jp [at]を@に置換してください。
▼本件に関する問い合わせ先
入試・広報センター
住所:東京都八王子市堀之内1432-1
TEL:042-676-4921
FAX:042-676-8961
メール:kouhouka@toyaku.ac.jp
【リリース発信元】 大学プレスセンター https://www.u-presscenter.jp/