東京薬科大学の多田塁准教授、根岸洋一教授らの研究グループは、ソニア社との共同研究により、キャビテーション気泡を制御する新しい強力集束超音波技術「Trigger HIFU」が、治療部位の腫瘍だけでなく遠隔部位の未治療腫瘍も縮小させる「アブスコパル効果」を誘導することを実証しました。本研究の成果は、従来のHIFUが主に局所的な効果に限定されていたのに対し、制御されたキャビテーションによる機械的破壊が強力な免疫応答を誘導できることを示し、非侵襲的でありながら原発巣と転移巣の両方を治療できる新しいがん免疫療法の戦略を提示するものです。
1.ポイント
■ キャビテーション気泡を制御する新しい強力集束超音波技術「Trigger HIFU」に対応したソニア・セラピューティクス株式会社(ソニア社)開発の装置を用いた共同研究により、治療部位だけでなく遠隔部位の未治療腫瘍も縮小させることに成功
■ 免疫チェックポイント阻害剤との併用により、単独治療を上回る顕著な治療効果を実証
■ Trigger HIFUにより活性化CD8陽性T細胞が全身の腫瘍を攻撃する「アブスコパル効果」のメカニズムを解明
■ 非侵襲的でありながら原発巣と転移巣の両方を治療できる新しいがん免疫療法の戦略を提示
2.概要
東京薬科大学の多田塁准教授、根岸洋一教授らの研究グループは、ソニア社との共同研究により、キャビテーション気泡を制御する新しい強力集束超音波技術「Trigger HIFU」が、治療部位の腫瘍だけでなく遠隔部位の未治療腫瘍も縮小させる「アブスコパル効果」を誘導することを実証しました。この効果は、治療により腫瘍細胞が免疫原性細胞死(immunogenic cell death)を起こし、傷害関連分子パターン(DAMPs)を放出し、CD8陽性T細胞や樹状細胞が活性化され、全身性の抗腫瘍免疫応答が誘導されることによるものです。さらに、免疫チェックポイント阻害剤(抗PD-1抗体)との併用により、単独治療を上回る顕著な治療効果が得られることも明らかにしました。本研究の成果は、従来のHIFUが主に局所的な効果に限定されていたのに対し、制御されたキャビテーションによる機械的破壊が強力な免疫応答を誘導できることを示し、非侵襲的でありながら原発巣と転移巣の両方を治療できる新しいがん免疫療法の戦略を提示するものです。この発見は、外科手術が困難な深部腫瘍や複数の転移巣を有する患者に対する新たな治療選択肢として期待されます。本成果は、国際学術誌「International Immunopharmacology」に掲載されました。
3.研究背景
がんは日本における死因の第1位であり、患者に負担の少ない非侵襲的かつ効果的な治療法の開発が強く求められています。外科手術や放射線療法などの局所治療は体への負担が大きく、特に転移したがんへの対応が困難です。化学療法は全身に作用するため転移がんにも用いられますが、強い副作用や効果が限定的な場合があるという課題があります。
近年、体外から超音波を集束させて腫瘍を破壊する強力集束超音波(HIFU:High-Intensity Focused Ultrasound)が、メスを使わない治療法として注目を集めています。HIFUは子宮筋腫や前立腺がんなどの治療に既に用いられていますが、これまでは主に局所的な腫瘍破壊にとどまっており、体内の他の場所にある転移巣への効果は限定的でした。
一方、がん免疫療法の分野では、ある部位のがん治療が免疫系を活性化させ、治療していない遠隔部位のがんまで縮小させる「アブスコパル効果」が注目されています。しかし、従来のHIFUでこの効果を十分に引き出すことは困難でした。従来のHIFUは主に60~100℃の高温で腫瘍を熱凝固させますが、この高温は免疫を活性化する重要な分子を変性させてしまい、免疫応答を抑制する可能性があるためです。
4.研究の内容
本研究では、まずマウスを使った実験動物モデルで新しい超音波技術の効果を確かめ、次にその効果がなぜ現れるのか、体の中でどのような仕組みが働いているのかを詳しく調べました。さらに、この技術を他の治療法と組み合わせることで、より高い効果が得られるかも検証しました。
■Trigger HIFU技術の特徴
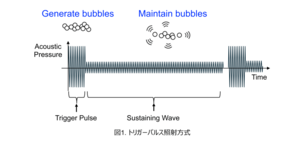
本研究で用いたTrigger HIFUは、高強度の短パルス(Trigger Pulse)でキャビテーション気泡を発生させ、その後の低強度持続波(Sustaining Wave)で気泡を維持するという独自の方式です(図1.トリガーパルス照射方式)。従来のHIFUが主に高温(60~100℃)での熱凝固で腫瘍を破壊するのに対し、Trigger HIFUは「キャビテーション気泡」という微小な気泡を発生させ、適度な熱による効果と気泡振動による機械的な効果の両方を統合的に実現できます。この「ほどよいバランス」が、免疫を活性化する重要な物質を壊さずに保ちながら腫瘍を破壊できるため、免疫システムの活性化において重要な役割を果たします。
■研究方法
研究グループは、マウスの両側の腹部に大腸がん細胞(MC38)を移植し、右側に大きな腫瘍、左側に小さな腫瘍を作製しました。右側の腫瘍のみにTrigger HIFU治療を実施し、両側の腫瘍体積の変化を観察しました。
■局所効果と遠隔効果(アブスコパル効果)
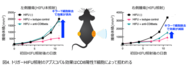
治療を行った右側の腫瘍が縮小しただけでなく、治療を行っていない左側の腫瘍も有意に縮小することが確認されました(図2.トリガーHIFU照射による腫瘍治療効果)。組織学的解析では、治療した腫瘍において腫瘍構造の著しい破壊と大量の免疫細胞浸潤が観察されました。さらに、Trigger HIFU治療により、腫瘍細胞がアポトーシスを起こすことがTUNEL染色により確認されました。重要なことに、治療していない遠隔部位の腫瘍でもTUNEL陽性細胞が増加しており、全身性の免疫応答が腫瘍細胞死を誘導していることが示されました。
■免疫細胞の活性化と浸潤
フローサイトメトリー解析により、治療側だけでなく未治療側の腫瘍においても、CD8陽性細胞傷害性T細胞が、治療側だけでなく未治療側でも優位に増加し、CD11c陽性樹状細胞も両側で有意に増加していることが明らかになりました(図3.トリガーHIFU照射は腫瘍に浸潤するキラーT細胞および樹状細胞をを増加させる)。さらに、フローサイトメトリーデータのt-SNE解析により、治療後の腫瘍内に15種類の異なるT細胞サブセットと8種類の樹状細胞サブセットが存在することが明らかになりました。特に、CD8⁺CD44⁺CD62L⁻の表現型を持つエフェクターT細胞や、CD8⁺CD44⁺CD62L⁺のセントラルメモリー様T細胞が顕著に増加していました。興味深いことに、これらのポピュレーションにはCD4も陽性のT細胞が存在していました。CD4とCD8のダブル陽性T細胞は腫瘍免疫活性が強いことが知られています。さらに、樹状細胞においてはF4/80も陽性な所謂、樹状細胞様マクロファージでした。
■CD8陽性T細胞の必須性
CD8陽性T細胞を抗体で除去する実験を行ったところ、未治療側の抗腫瘍効果が完全に消失しました(図4.トリガーHIFU照射のアブスコパル効果はCD陽性T細胞によって担われる)。これにより、CD8陽性T細胞がTrigger HIFUによる遠隔効果に不可欠であることが証明されました。
■免疫チェックポイント阻害剤との併用効果
治療後にPD-1を高発現する疲弊したT細胞が増加することが観察されたため、Trigger HIFUと抗PD-1抗体を併用したところ、単独治療を大きく上回る抗腫瘍効果が得られました(図5.トリガーHIFU照射の抗腫瘍活性は免疫チェックポイント阻害剤の併用で増強する)。
5.研究の意義と今後の期待
■学術的意義
本研究は、トリガーHIFU方式が、従来の熱凝固主体のHIFUよりも強力な免疫応答を誘導できる可能性を示しました。また、局所治療が全身性の抗腫瘍免疫を誘導するアブスコパル効果のメカニズムを、詳細な免疫学的解析により明らかにした点も重要です。CD8陽性T細胞の必須性、樹状細胞の活性化、DAMPsの放出という一連の免疫カスケードを包括的に示したことで、基礎研究においても重要な知見を提供するものです。
■臨床応用への期待
この新しい治療法は、以下のような患者さんへの応用が期待されます:
・手術が困難な患者さん:体の深い場所にある腫瘍や、重要な臓器に近い腫瘍で手術が難しい場合
・体への負担を減らしたい患者さん:高齢の方や持病がある方など、大きな手術に耐えられない場合
・転移があるがん患者さん:複数の場所にがんが広がっている場合でも、一箇所を治療することで全身に効果が期待できる
■今後の研究展開
本研究はマウスを用いた基礎研究ですが、今後は以下のステップで研究を推進していきます。
まず、大腸がん以外のさまざまな種類のがん(肺がん、膵臓がんなど)でも同じ効果が得られるかを確認します。さらに、化学療法剤(ゲムシタビンなど)、他の免疫療法薬(抗CTLA-4抗体など)や、がんワクチンなどとの組み合わせについても研究を進めます。
本技術が実用化されれば、多くのがん患者さんに新たな治療の選択肢と希望をもたらすことが期待されます。
6.用語解説
強力集束超音波(HIFU):体外から超音波を一点に集束させ、その焦点部分の組織を破壊する治療法。メスを使わない非侵襲的治療として注目されている。
アブスコパル効果:局所的ながん治療が免疫系を活性化させ、治療していない遠隔部位のがんまで縮小させる現象。「abscopal」はラテン語の「ab(離れた)」と「scopus(標的)」に由来する。
キャビテーション:減圧によって液体中に気泡が発生・成長・崩壊する現象。制御されたキャビテーションは、組織を機械的に破壊する効果がある。
DAMPs(傷害関連分子パターン):細胞が損傷を受けた際に放出される分子で、免疫系を活性化させる。ATPやHMGB1などが代表的。
CD8陽性T細胞:細胞傷害性T細胞とも呼ばれ、がん細胞や感染細胞を直接攻撃して破壊する免疫細胞。
樹状細胞:免疫系において抗原提示を行う細胞。がん細胞由来の抗原をT細胞に提示し、抗腫瘍免疫応答を開始させる。
免疫チェックポイント阻害剤:PD-1やCTLA-4などの免疫チェックポイント分子の働きを阻害し、T細胞の抗腫瘍活性を回復させる薬剤。がん免疫療法の主要な治療法の一つ。
7.論文情報
■論文タイトル Cavitation bubble-assisted high-intensity focused ultrasound induces abscopal immune responses(キャビテーション気泡を用いた高強度集束超音波による遠隔免疫応答の誘導)著者Rui Tada, Taiki Yamaguchi, Takashi Kanno, Yoko Endo-Takahashi, Mai Hayakawa, Yosuke Togashi, Shin Yoshizawa, Yoshiyuki Adachi, Yoichi Negishi
■掲載誌 International Immunopharmacology
■巻号・ページ Volume 166, 2025, 115565
■DOI 10.1016/j.intimp.2025.115565
8.研究支援
本研究は、ソニア・セラピューティクス株式会社からの資金提供による共同研究として実施されました。
9.研究体制
研究代表者
多田 塁(東京薬科大学・薬学部・免疫学教室・准教授)
根岸 洋一(東京薬科大学・薬学部・薬物送達学教室・教授)
共同研究者
ソニア・セラピューティクス株式会社
山口 泰暉(東京薬科大学・薬学部・薬物送達学教室)
菅野 峻史(東京薬科大学・薬学部・免疫学教室・助教)
高橋 葉子(東京薬科大学・薬学部・薬物送達学教室・講師)
早川 舞(東京薬科大学・薬学部・免疫学教室)
安達 禎之(東京薬科大学・薬学部・免疫学教室・教授)
---
研究に関するお問い合わせ
東京薬科大学 薬学部 免疫学教室 准教授 多田 塁(ただ るい)
TEL:042-676-5616
E-Mail:ruitada[at]toyaku.ac.jp *[at]を@に置換してください。
▼本件に関する問い合わせ先
入試・広報センター
住所:東京都八王子市堀之内1432-1
TEL:042-676-4921
FAX:042-676-8961
メール:kouhouka@toyaku.ac.jp
【リリース発信元】 大学プレスセンター https://www.u-presscenter.jp/