~動物とは異なる”植物ならでは”の仕組みを発見~
横浜市立大学大学院生命医科学研究科 構造生物学研究室(エピジェネティクス構造生命科学)の菊地杏美香さん(博士課程2年)、有田恭平教授、東京大学医科学研究所の西山敦哉准教授、東京科学大学の藤泰子准教授らを中心とした研究グループは、植物のDNAメチル化を維持するDNA維持メチル化酵素MET1の構造を、クライオ電子顕微鏡(クライオ電顕)単粒子解析法*1で明らかにしました(図1)。本研究成果は、植物独自のDNAメチル化維持の理解を深め、温度変化や乾燥などの環境ストレスに強い植物の創出に貢献する可能性があります。本研究成果は、「Nature Communications」に掲載されました(2025年9月26日公開)。
研究成果のポイント
クライオ電顕で植物のDNA維持メチル化酵素MET1の活性化状態と自己阻害状態の構造の可視化に成功。
MET1は片鎖メチル化CG配列を含むDNA*2を特異的にメチル化し、DNAの認識やメチル化の反応機構は動植物間で高度に保存されていた。
動物と植物のメチル化酵素で、自己阻害の機能は保存されているものの、その分子メカニズムは全く異なることを発見した。
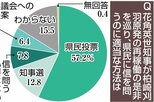
MET1の自己阻害解除の因子の一つとしてユビキチン化*3されたヒストンH3*4タンパク質を同定した。
立体構造に基づいた改変型MET1の設計は、農業や食料問題への解決に貢献できると期待される。
[画像1]https://digitalpr.jp/simg/1706/119100/600_401_2025093016081268db81dc8acc1.png
図1: 本研究の概要
本研究では、植物のDNA維持メチル化酵素MET1の全長構造(左)と片鎖メチル化DNAが結合したMET1の複合体構造(右)をクライオ電子顕微鏡で明らかにした。
研究背景
多くの生物において、遺伝子の使い方はエピジェネティクスとよばれる生命現象が制御しています。DNAのシトシン塩基にメチル基を付加するDNAメチル化は、遺伝子のはたらきを抑制するエピジェネティクスの一つです。我われの身体を構成する細胞が、同じDNA配列を持ちながらも多種多様な形や働きを持つのは、DNAメチル化により働く遺伝子が細胞ごとに決められているからです。細胞が一度獲得したDNAメチル化情報は、細胞分裂後も「DNA維持メチル化*5」とよばれる生命現象によって、個体の生涯に渡って正確に継承されます。DNA維持メチル化の破綻は、細胞のがん化や老化などのさまざまな疾患の原因となり、この研究分野は重要な社会問題の解決につながります。
動物のDNA維持メチル化はCG配列中のシトシン塩基に起こり、その情報はDNA維持メチル化酵素DNMT1が維持します。我われの研究などによって、DNMT1の構造生物学*6的な研究が進み、動物におけるDNA維持メチル化の仕組みの大半を理解できるようになってきました(Kikuchi et al., Nat. Commun. 2022: 2022年11月記者発表: 細胞運命を決定するタンパク質DNMT1の活性制御機構を解明 https://www.yokohama-cu.ac.jp/news/2022/202211arita_natcommun.html
)。一方、植物ではDNMT1のオルソログ*7であるMET1がDNA維持メチル化に重要な役割を果たします。DNMT1とMET1はドメイン*8構成が似ていることから、植物と動物におけるDNAメチル化は同様の仕組みによって維持されていると、多くの研究者が長年に渡って考えてきました。しかし、MET1の立体構造が解明されていなかったことから、植物のMET1が動物のDNMT1と同じ原理で働くのかは、未解決の重要な問題として残されていました。植物のDNAメチル化が正しく維持されないと、発育異常や熱などのストレス応答制御の異常を引き起こすことが知られています。そのため、MET1が制御するDNA維持メチル化のメカニズムを明らかにすることは、植物の環境適応による生存戦略を理解する上で重要です。今回研究グループは、シロイヌナズナのMET1単体の構造、および片鎖メチル化DNAが結合した複合体構造を、クライオ電子顕微鏡を用いた単粒子解析法で決定し、MET1による植物のDNAメチル化維持の原理を解明することを目指しました。
研究内容
本研究では、まず植物のDNAメチル化酵素MET1のDNAメチル化活性の特性を調べるために、試験管内でMET1の機能を評価しました。その結果、MET1は片鎖メチル化CG配列を含むDNAだけを特異的にメチル化することが分かりました。これまでの研究から、動物のDNMT1は、N末端にあるRFTSドメインがC末端にあるDNA結合ポケットに蓋をしてDNA結合を妨げる、いわばブレーキが掛けられた自己阻害状態を取ることが報告されています。植物MET1は2つのRFTSドメインを持っているため、これらがDNMT1と同じようにDNA結合を阻害するかを確かめました。その結果、2つのRFTSドメインを取り除いた触媒ドメインだけのMET1は、全長MET1と比較してDNAメチル化活性が15倍高いことがわかりました。つまり、植物のメチル化酵素も動物と同様に自己阻害状態をとり、それには2つのRFTSドメインが関与していることが分かりました(図2)。
[画像2]https://digitalpr.jp/simg/1706/119100/600_405_2025093016103768db826d73213.png
図2 MET1のドメイン構造(上)とDNAメチル化活性の評価(下)
活性実験で使用した触媒ドメインのみのMET1 (MET1MTase) は、ドメイン構造下部の赤矢印で示した領域から構成される。活性実験では、MET1の片鎖メチル化DNAに対するメチル化効率を、全長MET1(MET1全長, 青)とユビキチン化H3存在下の全長MET1(MET1全長+ユビキチン化H3, オレンジ)、そしてMET1MTase (赤)で比較した。
次に、基質である片鎖メチル化DNAが結合したMET1とMET1単体の立体構造を、クライオ電子顕微鏡を用いた単粒子解析法で決定し、MET1の活性化状態と自己阻害状態を可視化しました。測定は理化学研究所(横浜キャンパス)の加速電圧300 kVのクライオ電子顕微鏡を使用し、原子レベルの分解能でMET1の立体構造を決定しました。この構造解析により、植物と動物のメチル化酵素でどのような原理が保存され、どのような原理が植物独自なのかが明らかになりました。
活性化型MET1とDNMT1の構造を比較すると、基質である片鎖メチル化DNAの結合様式や、メチル化反応に働くアミノ酸の配置が、MET1とDNMT1でよく一致していることがわかりました。このことから、DNAメチル化を付加するメカニズムは、動物と植物の間で高度に保存されていることが分かりました。次に、自己阻害型のMET1とDNMT1の構造を比較すると、自己阻害に関与するRFTSドメインの触媒ドメインへの入り方が上下逆向きであることがわかりました。DNMT1では、RFTSドメインのC末端領域(図3のオレンジ色)が触媒ドメイン(図3の黄色)に入り込んで自己阻害構造を取る一方で、MET1では、RFTS2ドメインのN末端領域(図3の青色)が触媒ドメインに入り込んでいました。さらに構造を詳しく見ると、MET1にはDNMT1にはない、DNA結合を阻害する新たな領域(connecting linker、図3の赤色)があることを発見しました。
[画像3]https://digitalpr.jp/simg/1706/119100/600_296_2025093016104068db8270280a2.png
図3 植物のメチル化酵素MET1単体(左)と動物のメチル化酵素DNMT1単体(右)の構造比較
MET1の触媒ドメイン(黄)にはRFTS2ドメインのN末端領域(青)が、DNMT1の触媒ドメインにはRFTSドメインのC末端領域(オレンジ)が入り込んでいる。さらに、MET1におけるDNA結合の阻害は、RFTS2ドメインだけでなくconnecting linker(赤)も関与することを発見した。
動物のDNMT1の自己阻害の解除には、ユビキチン化ヒストンH3のRFTSドメインへの結合が重要であることが知られています(Ishiyama et al., Moll Cell 2017: 2017年10月記者発表: 細胞固有の性質が遺伝する仕組みを解明 https://www.yokohama-cu.ac.jp/news/2017/20171018kenkyu.html
)。植物MET1もユビキチン化H3により自己阻害が解除され、DNAメチル化活性が促進されるか調べるために、ユビキチン化H3存在下での全長MET1のDNAメチル化活性を評価しました。その結果、ユビキチン化H3はMET1のDNAメチル化活性を促進し、自己阻害の解除に働くものの、その活性は触媒ドメインのみのMET1のDNAメチル化活性には至らないことがわかりました(図2)。このことから、ユビキチン化H3は部分的にMET1の自己阻害を解除するものの、MET1の完全な活性化には動物とは異なる新たな因子が必要である可能性が示されました。
今後の展開
これまでの植物のDNAメチル化の研究は、遺伝子を欠損させた際に生じる形質変化を解析する遺伝学的研究が中心に行われ、その機能を担う実体であるタンパク質分子の詳細な構造や作用機序に関する研究は、ほとんど手つかずの領域として残されていました。本研究では、クライオ電子顕微鏡によって、植物のDNAメチル化で重要な働きをするMET1の働きを可視化することに成功しました。MET1の立体構造情報から、植物と動物のDNAメチル化酵素間で自己阻害の機能は保存されているものの、そのメカニズムは全く違うことを明らかにしました。植物のDNAメチル化は、環境変化に適応するために世代を超えて継承されるので、植物の生存に重要であると考えられています。今回の研究成果に基づいて、例えばCG配列以外のDNA配列もメチル化できるなどの、新しい機能を付加した改変型MET1が作成できれば、乾燥や高温といった様々なストレスに強い植物を生み出せる可能性があります。これにより、将来的には農業や食料問題への解決に貢献できることが期待されます。
研究費
本研究は、JSPS科研費 (JP19H05741, 24K01967, 24K21950, 25H01301)をはじめ、横浜市立大学学長裁量事業 戦略的研究推進事業(SK201904)、次世代研究者挑戦的研究プログラム (JPMJSP2179) 、笹川科学研究助成などの助成を受けて行われました。
論文情報
タイトル:Cryo-EM reveals evolutionarily conserved and distinct structural features of plant CG maintenance methyltransferase MET1
著者:Amika Kikuchi, Atsuya Nishiyama, Yoshie Chiba, Makoto Nakanishi, Taiko Kim To, Kyohei Arita
掲載雑誌:Nature Communications
DOI:https://doi.org/10.1038/s41467-025-63765-9
[画像4]https://digitalpr.jp/simg/1706/119100/500_74_2025093016185068db845a50032.png
用語説明
*1 クライオ電子顕微鏡(クライオ電顕)単粒子解析法:タンパク質などの生体分子の立体構造を明らかにする手法の一つ。生体分子を急速に凍結させ、その状態を電子顕微鏡で観測する。単粒子解析法により、異なる向きから撮影された多数の粒子像をもとに3次元に再構成することで、生体分子の立体構造を明らかにする。2017年にノーベル化学賞を受賞した技術である。
*2 片鎖メチル化DNA:CG配列は回文構造をとるため、DNAの両鎖に対称的にメチル化が起こり、これがDNAメチル化として機能する。DNAが複製する際、新たに合成される新生鎖にはDNAメチル化の情報が引き継がれないため、親鎖のみがメチル化された片鎖メチル化DNAが一過的に生じる。
*3 ユビキチン化:基質となるタンパク質のリジン残基に、球状タンパク質のユビキチンが共有結合で付加される翻訳後修飾。基質に付加されたユビキチンのリジン残基には、さらにユビキチンが数珠状に付加されることがあり、タンパク質分解やシグナル伝達、DNA損傷修復などのタンパク質の機能を制御する。
*4 ヒストンH3:ヌクレオソームを構成する5種類のヒストンタンパク質のうちの一つであり、ゲノムDNAを巻き付かせて核内に収納させる役割をもつ。ヒストンH3のN末端はメチル化やアセチル化などの化学修飾を受け、遺伝子発現の制御に関与する。
*5 DNA維持メチル化:DNA複製期で産出された片鎖メチル化DNAを両鎖メチル化DNAに戻す生命現象。細胞が分化の過程で獲得したDNAメチル化情報は、細胞分裂を経ても娘細胞に正確に継承される。DNA維持メチル化により、細胞の形質を保ったまま増殖することができる。
*6 構造生物学:タンパク質やDNA、およびその複合体などの生体分子の立体構造を決定し、その立体構造情報に基づいて生命現象を理解する学問。X線結晶構造解析やクライオ電子顕微鏡などの手法を用いて、原子レベルで生体分子を観察する。生命現象の理解に加えて、創薬研究に直結する基盤的な研究分野である。
*7 オルソログ:共通の祖先遺伝子に由来し、種分化により異なる生物に受け継がれた相同の機能を持つ遺伝子。多くの場合、異なる種間でも同様の機能を持つ。
*8 ドメイン:タンパク質の中に存在する構造単位で、その部分だけで安定した立体構造をとり、独立した機能を持つ。複数のドメインが組み合わさることで、タンパク質全体の多様な構造と機能が決まる。